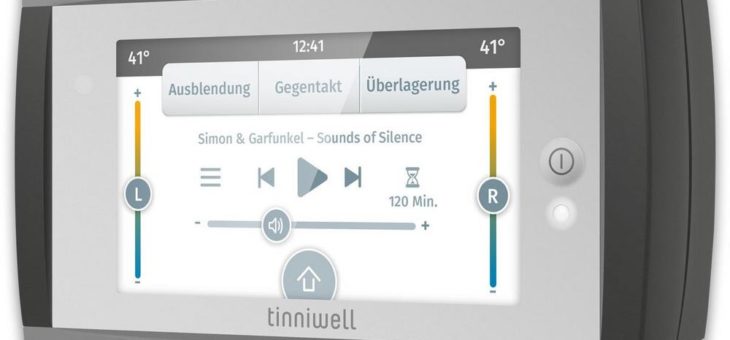
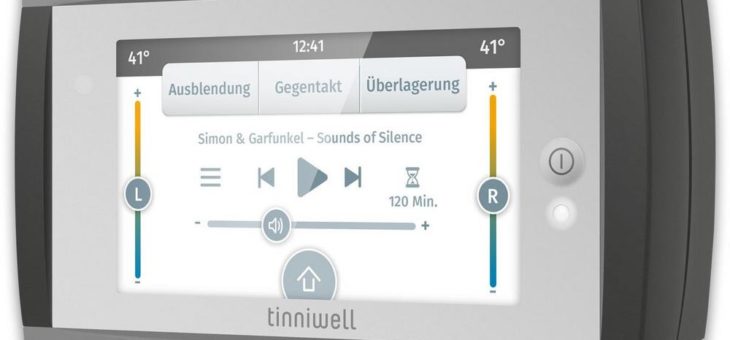
Resaphene Suisse AG: FDA-Zulassungsprozess für Tinnitus-Therapie tinniwell wird fortgesetzt
Aufgrund der COVID-Pandemie wurden die Arbeiten für die FDA-Zulassung des tinniwell Anfang 2021 eingestellt. Diese wurde nun wieder aufgenommen und mit der Projektleitung wird der Chief Medical Officer Thomas Rauterkus beauftragt. Ziel ist es, dieses Projekt binnen 12 Monaten abzuschliessen und so den Eintritt in den Medizintechnik-Markt in den USA zu schaffen. Derzeit schätzen wirRead more about Resaphene Suisse AG: FDA-Zulassungsprozess für Tinnitus-Therapie tinniwell wird fortgesetzt[…]